#Herz-Kreislauf-Forschung
Die Familie aus dem Emsland
Text: Philipp Grätzel von Grätz
Herzinfarkte haben viel mit Cholesterin zu tun, das weiß jeder. Doch Genomforscher kennen heute viele Mechanismen, die das Infarktrisiko erhöhen. Damit rücken neue Behandlungs- und Präventionskonzepte in den Blick.
Im Jahr 1998 wurde Professor Heribert Schunkert, heute Direktor der Kardiologie am Deutschen Herzzentrum München, auf eine große Familie aus dem Emsland aufmerksam, in der auffallend viele Herzinfarkte auftraten. Den Anfang machte eine 50-jährige Patientin. Es stellte sich heraus, dass es sieben Geschwister und etwa dreißig Cousins und Cousinen gab – viele von ihnen hatten ebenfalls Herzinfarkte erlitten. „Wir waren uns sehr sicher, dass es eine genetische Ursache geben musste“, erinnert sich Professorin Jeanette Erdmann, die damals zu Schunkerts Arbeitsgruppe stieß. Heute leitet sie als DZHK-Professorin das Institut für Kardiogenetik an der Universität zu Lübeck.
Der lange Weg vom Gen zur Erkenntnis
Um die Jahrtausendwende war Genomforschung noch mühsam. Die Wissenschaftler suchten vergeblich nach einer Genvariante, die die extreme Häufung von Infarkten in dieser Familie erklären konnte. Doch die Methoden entwickelten sich weiter. Die Sequenzierung ganzer Genome wurde kostengünstiger. Gleichzeitig entstanden immer mehr Kohorten von Menschen, die zu Forschungszwecken ihre medizinischen und genetischen Daten zur Verfügung stellten.
DER HERZINFARKT WAR
NAHEZU UNAUSWEICHLICH.
Solche Patientenkohorten ermöglichen seit etwa 15 Jahren die genetische Forschung in großem Maßstab. Ein wichtiges Instrument sind genomweite Assoziationsstudien, kurz: GWAS. Dabei werden Millionen Genvarianten bei Herzinfarktpatienten mit denen bei gesunden Menschen verglichen. Bis heute wurden an etwa 250 Orten im Genom Risikogene für Herzinfarkte identifiziert. „Am Ende werden es circa 400 sein“, schätzt Schunkert. Einige wenige sind sehr selten und erhöhen das Risiko sehr stark. Dazu gehören Mutationen im Rezeptor für das „böse“ LDL-Cholesterin. „Die große Mehrheit der Risikoallele, also der ungünstigen Genvarianten, erhöht das Infarktrisiko aber nur leicht. Hier hängt das Gesamtrisiko davon ab, wie viele Risikoallele eine Person mitbringt.“
DIE WISSENSCHAFTLER SUCHTEN VERGEBLICH NACH EINER GENVARIANTE, DIE DIE EXTREME HÄUFUNG IN DIESER FAMILIE ERKLÄREN KONNTE.
Leider verrät nicht jedes Gen sofort, warum es problematisch ist. Hier wurden in den letzten Jahren aber große Fortschritte erzielt: Risikogene für Herzinfarkt finden sich nicht nur im Fettstoffwechsel, sondern auch bei der Blutdruckregulation, der Gerinnung, der Blutgefäßneubildung, der Regeneration der glatten Muskelzellen und den immunologischen Signalwegen.
Die Lösung des Emsland-Rätsels
Die Familie aus dem Emsland hat das Team um Heribert Schunkert und Jeanette Erdmann nicht aus den Augen verloren: „Wir konnten irgendwann die Gensequenzierung bei drei Patienten finanzieren“, so Erdmann. Mit Erfolg: Eine sehr seltene Variante in einem Gen namens GUCY1A3 fand sich bei fast allen betroffenen Familienmitgliedern. „Parallel tauchte ein häufiges Allel von GUCY1A3 in einer GWAS-Studie auf. Das war für uns die Bestätigung, dass wir richtig lagen.“
VIELSCHICHTIG
Forscher kennen immer mehr Mechanismen für die Entstehung der Atherosklerose am Herzen, die (auch) genetisch bedingt sind:
– Fettstoffwechselstörungen
– Erhöhter Blutdruck
– Störungen bei der Blutgefäßneubildung
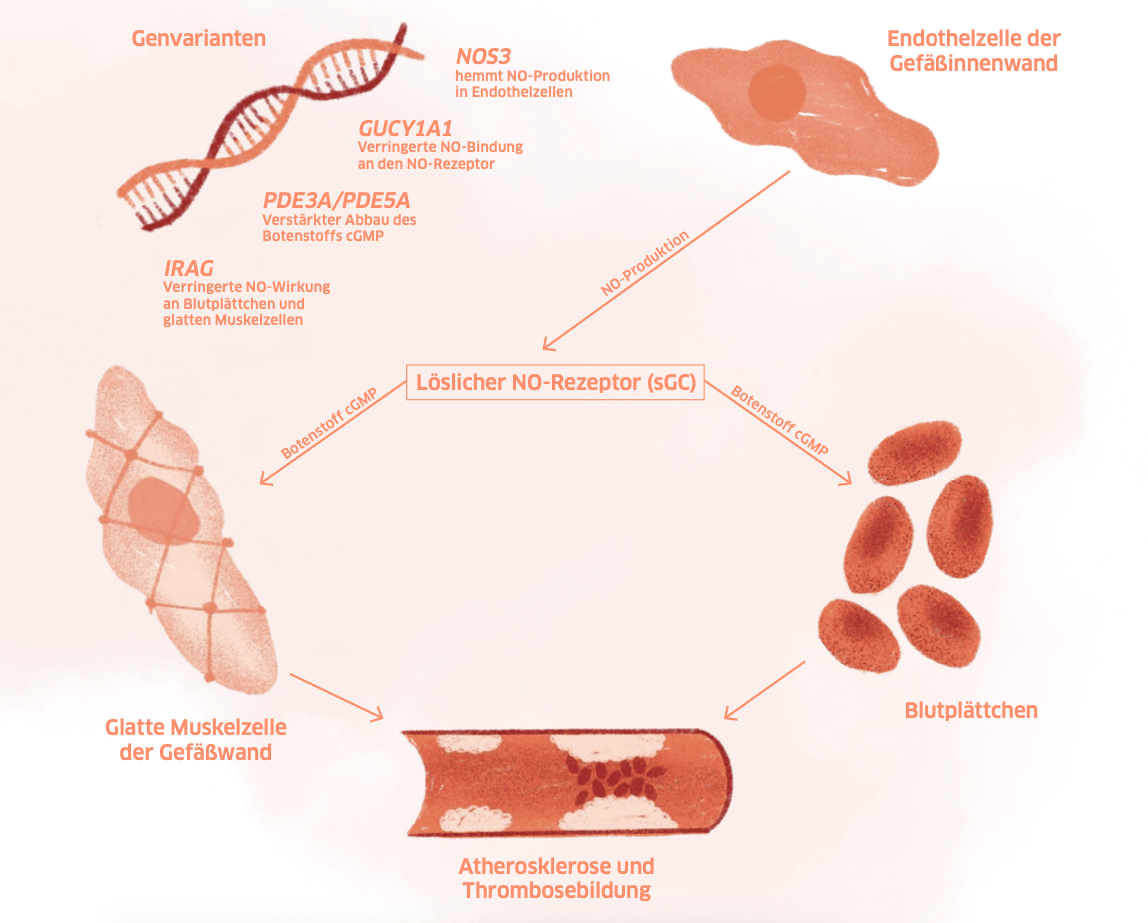
– Störungen im NO-Signalweg
– Gestörte Umbauprozesse der Blutgefäßwand
– Entzündungsprozesse
– Defekte beim Ablesen der Gene
Dass die Mutation in GUCY1A3 nicht früher aufgefallen war, lag an einer Besonderheit: Sie allein erhöhte das Herzinfarktrisiko nur moderat. Das Unglück der Familie aus dem Emsland war, dass noch eine Mutation hinzukam. Die lag in einem Gen, das mit GUCY1A3 interagiert. Lag bei einer Person die extrem seltene Kombination beider Mutationen vor, war der Herzinfarkt fast unausweichlich.
Doch warum GUCY1A3? „Um das zu klären, haben wir mit Blutplättchen gearbeitet“, erläutert PD Dr. Thorsten Kessler vom Deutschen Herzzentrum München.
GUCY1A3 kodiert für eine Untereinheit des Enzyms lösliche Guanylatcyclase (sGC), das unter anderem in Blutplättchen vorkommt. Die sGC ist der Rezeptor für Stickstoffmonoxid, kurz NO. Dockt NO an, bildet die sGC den Botenstoff cGMP. Er verhindert, dass die Blutplättchen „übereifrig“ werden und zu viele Gerinnsel bilden. Genau diese NO-abhängige cGMP-Bildung funktioniert bei Menschen mit GUCY1A3 Risikoallel nur schlecht. Und bei der seltenen Mutationskombination der Familie aus dem Emsland funktioniert sie gar nicht mehr. Die Folge: Das Risiko für eine Atherosklerose und damit für Herzinfarkte steigt.