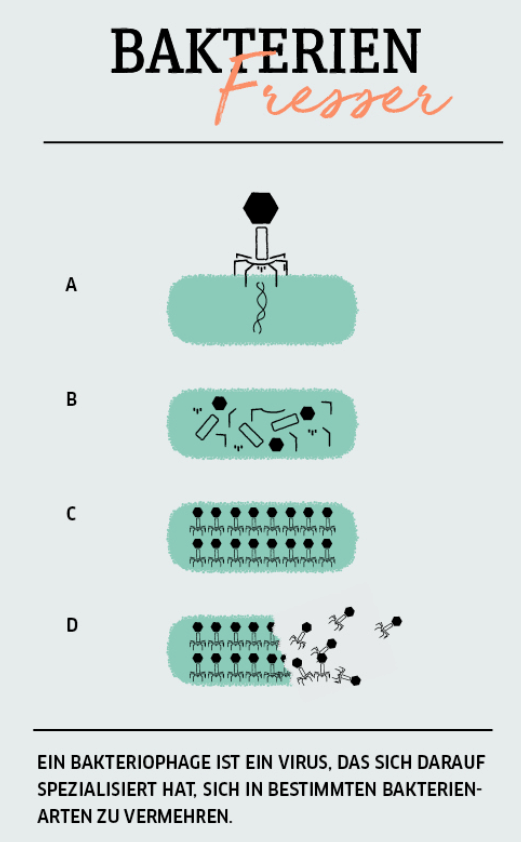
Das aus dem Griechischen kommende Wort „Bakteriophage“ bedeutet „Bakterienfresser“. Bakteriophagen sind Viren: Sie können sich nur vermehren, indem sie ihr Erbgut in Bakterien injizieren und deren Replikationsmaschinerie für ihre Zwecke ausnutzen. Sind die neuen Phagen „reif“, platzt die Wirtszelle – und stirbt. Dieser Effekt wird schon seit den 1920er-Jahren in den Staaten der ehemaligen Sowjetunion therapeutisch genutzt, vor allem als Ersatz für Antibiotika, an denen es dort aus Kostengründen lange mangelte. Bis heute reisen Patientinnen und Patienten aus aller Welt mit hartnäckigen Infektionen in die georgische Hauptstadt Tiflis, dem Mekka der Phagentherapie, um über Apotheken an für sie individuell gemischte Phagencocktails zu gelangen.
„Nicht immer war die Therapie erfolgreich. Das lag jedoch, wie wir heute wissen, meist daran, dass zu wenig, manchmal die falschen und nicht gut aufgereinigte Phagen eingesetzt wurden“, sagt Dr. Christine Rohde, Mikrobiologin und Leiterin der Arbeitsgruppe „Klinische Phagen und gesetzliche Regulation“ am Leibniz-Institut DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen, einer Mitgliedseinrichtung des Deutschen Zentrums für Infektionsforschung (DZIF) in Braunschweig. Dort wird eine stetig wachsende Kollektion an Phagen und passenden Wirtsbakterien gesammelt, charakterisiert, gelagert und für die Forschung weltweit zur Verfügung gestellt.
Die Evolution nutzen
Voraussetzung für den Therapieerfolg ist ein ausführliches Phagogramm, bei dem der jeweilige Infektionserreger identifiziert und im Labor testweise passenden Phagen ausgesetzt wird. Denn wie ein Schlüssel ins Schloss passt eine Phagenspezies zu einer ganz bestimmten Bakterienart – weil nur sie mit ihren Schwanzfibern an den Oberflächenrezeptoren des Bakteriums andocken kann. So evolvieren Bakterien und ihre Viren seit Urzeiten gemeinsam – und finden sich, quasi als Paare, auch zuhauf im menschlichen Mikrobiom. „Medizinisch relevante Phagen suchen wir deshalb nicht nur in Kompost, Waldböden, Kot und Gülle aus dem hiesigen Zoo, sondern vor allem in Klinikabwässern", sagt Dr. Johannes Wittmann, Leiter der DSMZ-Arbeitsgruppe „Phagengenomik und -anwendung" und Experte für Phagen-Biodiversität. Die gesammelten Proben werden erst steril filtriert, um alle enthaltenen Mikroorganismen zu entfernen. „Dann ziehen wir die Bakterienspezies, gegen die wir Phagen suchen, an – quasi als Köder – und inkubieren sie mit der Umweltprobe." Bei Erfolg finden die Forschenden kleine Plaques, Löcher im Bakterienrasen, in denen Bakterien infiziert und abgetötet wurden. Von Agarplatten mit solchen Plaque-Löchern können die Phagen einfach „abgewaschen" und so gewonnen werden. Aus einer großen Zahl und Vielfalt von Phagen, die sich spezifisch gegen eine Bakterienspezies richten – beispielsweise das Bakterium Enterococcus faecium im Projekt EVREA-Phage (die Abkürzung steht für: Eradikation intestinaler Vancomycin-resistenter E. faecium (VRE) mittels oraler Phagentherapie) – werden dann über zahlreiche Tests einige wenige ausgesucht, die am effizientesten gegen diese Zielbakterien wirken.
Ein Virus als Medikament
Damit Phagentherapien auch in Deutschland endlich zugelassen werden, verlangt die Arzneimittelbehörde mindestens eine erfolgreiche, systematische, kontrollierte Studie, welche die Effizienz dieser Therapieform beweist. Christine Rohde ist zuversichtlich, denn mit „Phage4Cure“, einer vom Bundesministerium für Bildung und Forschung finanzierten Phase-I-Studie an der Charité – Universitätsmedizin Berlin, könnte das schon bald gelingen. Dort wird aktuell die Wirkung der Inhalation eines hochgereinigten Phagencocktails gegen Pseudomonas aeruginosa bei der Stoffwechselerkrankung zystische Fibrose (CF) und bei Non-CF-Bronchiektasen, einer chronischen Atemwegserkrankung, getestet.
Die Indikationsfelder für Phagentherapien sind vielfältig: Getrocknet und magensäureresistent verkapselt wären sie beispielsweise bei Darminfektionen einsetzbar. Selbst für die Behandlung von bakteriellen Hirnhautentzündungen sind sie ebenfalls interessant, denn im Gegensatz zu den meisten Arzneimitteln überwinden Phagen die Blut-Hirn-Schranke. „Breite Anwendung werden sie vor allem in der Behandlung oberflächlicher und tiefer Wunden finden, was wir aktuell mit dem Bundeswehrkrankenhaus in Berlin im Projekt ‚PhagoFlow‘ untersuchen“, betont Johannes Wittmann. Phagen sollen Antibiotika nicht ersetzen, sondern eine Alternative sein. Eine sehr sanfte sogar, denn ihre Lebensweise macht die Viren zu einzigartigen Arzneimitteln: Anders als Antibiotika zerstören sie nicht die Darmflora der Patientinnen und Patienten und sie replizieren sich nur, solange sie genau den Infektionserreger finden, auf den sie angesetzt wurden. Danach gehen die Phagen zugrunde und werden einfach vom Körper abgebaut.
Ganz bodenständig: Neue Antibiotika
Antibiotika werden weiterhin gebraucht. Aufgrund zunehmender Resistenzen ist die Forschung jedoch auf der Suche nach neuen Wirkstoffen. Die könnten sehr nah sein: Es muss kein Urwald durchkämmt oder in der Tiefsee nach seltenen Schwämmen getaucht werden – im Erdreich von Gärten, Äckern, Wäldern und Wiesen wimmelt es nur so von noch unbekannten, antibiotisch „hochgerüsteten" Bakterien- und Pilzarten. „Im Prinzip haben wir erst ein Prozent dieser Mikroorganismen aus der Umwelt kultivieren und diesbezüglich untersuchen können", sagt Prof. Tanja Schneider, DZIF-Forscherin an der Rheinischen Friedrich-Wilhelms-Universität Bonn. Das liegt unter anderem daran, dass manche Spezies extrem langsam wachsen – auch weil sie unter Umständen bestimmte Wachstumsfaktoren benötigen, die sie im natürlichen Habitat, aber nicht in künstlichen Labornährböden finden – und deshalb beim Anzüchten von Proben im Labor bisher schlicht übersehen wurden.
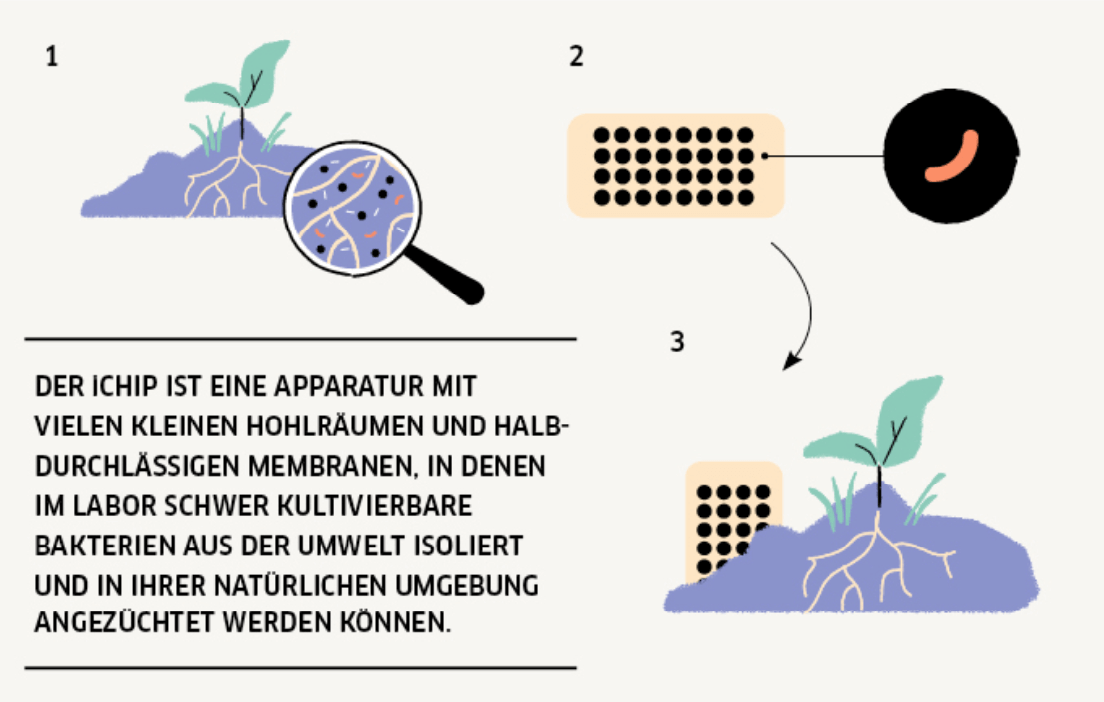
Mit der iChip-Technologie, die Kim Lewis und Slava Epstein, enge Kooperationspartner von Tanja Schneider an der Northeastern University in Boston, entwickelt haben, ändert sich das nun. Wird der Kunststoffchip in eine verdünnte Bodenprobe eingetaucht, werden in seinen 380 winzigen Hohlräumen Mikroorganismen einzeln gefangen. Der mit semipermeablen Membranen verschlossene Chip wird dann wieder genau in den Boden eingesetzt, aus dem die Probe stammt. Und dann beginnt das große Warten. Die Porengröße der Membranen erlaubt lediglich den Nährstoffaustausch mit der Umgebung. Andere Bakterien können aber nicht eindringen und die Vereinzelten überwuchern und abtöten.
„Auf diese Weise können jetzt rund 50 Prozent der vorher nicht kultivierbaren Bakterien aus einer Bodenprobe angezüchtet werden“, betont Tanja Schneider. So auch Eleftheria terrae sp. carolina, isoliert im Boden North Carolinas, die erst nach zwölf Wochen Kolonien bildete, danach dann aber auch in der Lage war, auf Labornährböden zu wachsen. Die in dem Bakterium entdeckten außergewöhnlichen Wirkstoffe Teixobactin und Clovibactin konnte das Forscherteam bereits entschlüsseln. Für die „Arbeitsweise“ von Teixobactin gelang ihr das im Rahmen der DZIF-Wirkmechanismus-Plattform „Antibiotic Mode of Action Platform“ bereits 2015. Und gemeinsam mit Markus Weingart, der an der Universität Utrecht in den Niederlanden die Struktur des neuartigen Antibiotikums im Komplex mit der Zielstruktur aufklärte, 2023 auch für Clovibactin.
MIT iCHIP KÖNNEN JETZT RUND 50 PROZENT DER VORHER NICHT KULTIVIERBAREN BAKTERIEN AUS EINER BODENPROBE ANGEZÜCHTET WERDEN.
Beide Substanzen sind komplexe, zyklische Moleküle, sogenannte Depsi-Peptide, die neben Peptid- auch Esterbindungen enthalten und eine völlig neuartige Klasse von Antibiotika darstellen. In der Natur kommen mehrheitlich L-Aminosäuren vor, doch zwei der acht Aminosäuren von Clovibactin sind D-Aminosäuren. „Clovibactin blockiert nicht nur an drei verschiedenen Zielstrukturen gleichzeitig die Zellwandsynthese, sondern löst Bakterienwände auch ungewöhnlich schnell auf.“ Tricks, die in Kombination pathogenen Keimen wenig Chancen lassen, Resistenzen gegen den Wirkstoff zu entwickeln, vermutet die Forscherin. Clovibactin scheint noch an andere Zielstrukturen der Bakterienzelle zu binden, was die Forschenden jetzt weiter untersuchen wollen. Auch anhand von Strukturvarianten des Wirkstoffs, sogenannten Derivaten, die Chemiker in verschiedenen Laboren synthetisch herstellen werden.
Weil die neuen Antibiotika aus einem gram-negativen Bakterium stammen, das über eine äußere Zellmembran verfügt, wirken sie besonders effektiv gegen gram-positive Keime, die diesen Schutzmantel nicht besitzen, zum Beispiel gegen den gefürchteten Krankenhauskeim MRSA (Methicillin-resistenter Staphylococcus aureus) und Mykobakterien wie den Tuberkuloseerreger. Gegen Letzteren soll Teixobactin nun weiterentwickelt werden.
Warum hat Eleftheria terrae diese Wirkstoffe entwickelt? „Das ist bakterielle Kriegsführung“, sagt Tanja Schneider. „Es geht um Konkurrenz. Darum, andere Organismen zu töten, um sich selbst Ressourcen zu sichern.“