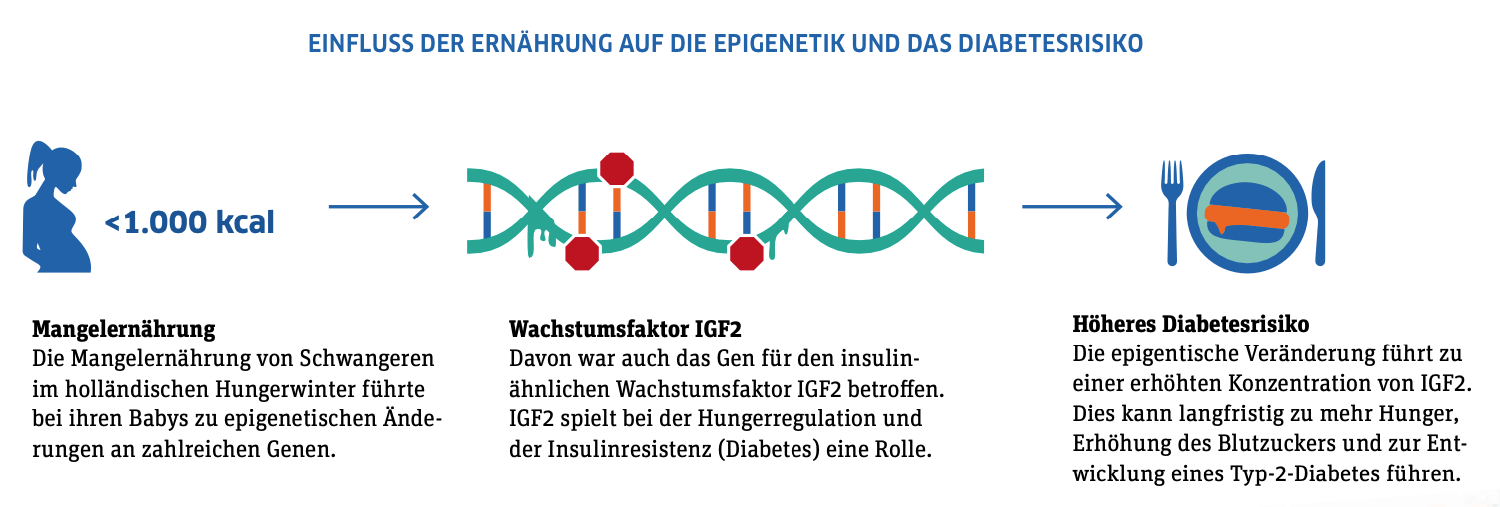
Holland im Oktober 1944: Seit vier Jahren herrscht Krieg und bis zu seinem Ende im Mai 1945 blockieren die deutschen Besatzer auch noch die Lebensmittelversorgung der niederländischen Provinz. Die Menschen hungern, die Mahlzeiten sind rationiert. Auch für schwangere Frauen: In den Geburtskliniken wird dokumentiert, wie viele Kalorien den teils stark unterernährten Müttern zugeteilt werden, dazu ihr Gewicht und das der Neugeborenen. Diese Informationen bilden den Grundstock für eine Langzeitstudie, die bis heute andauert und mittlerweile die medizinischen Daten mehrerer Generationen umfasst. Ihr Fazit: Die Lebensumstände von Eltern haben langfristige Auswirkungen auf die gesundheitliche Entwicklung ihrer Kinder und Enkel – und zwar unabhängig von deren eigenem Lebensstil.
Das zeigt sich an jenen Holländerinnen, die als Schwangere hungern mussten, in eindrucksvoller Weise. Obwohl ihre Kinder nach Kriegsende ausreichend zu essen hatten, waren sie als Erwachsene gesundheitlich beeinträchtigt: Sie waren häufiger als die Normalbevölkerung von Typ-2-Diabetes oder Herz- und Nierenerkrankungen betroffen. Bei ihren Töchtern traten überdurchschnittlich viele Fälle von Brustkrebs und anderen Tumoren sowie von Herz-Kreislauf-Erkrankungen auf. Im Gegensatz dazu waren die Söhne im fortgeschrittenen Alter anfälliger für Depressionen, Angststörungen und neurodegenerative Diagnosen. Wie gründliche Analysen ergaben, geht all dies nur bedingt auf die genetische Veranlagung der Betroffenen zurück. Entscheidend ist vielmehr die Ablesebereitschaft ihrer Gene, sprich: deren epigenetische Signatur. Diese wirkt wie ein chemisches Schloss, das den Zugang zu bestimmten DNA-Sequenzen verwehrt oder freigibt und damit kontrolliert, ob und wann bestimmte Gene ihre Wirkung entfalten können.
Hungerwinter als Paradebeispiel
Die gut untersuchten Folgen des holländischen „Hungerwinters“ gelten als Paradebeispiel für die Wirkmacht epigenetischer Veränderungen. „Wie wir heute wissen, sind diese allgegenwärtig: Manche verschwinden nach kurzer Zeit, andere bleiben ein Leben lang bestehen oder werden gar an nachfolgende Generationen weitergegeben. Somit erben wir von unseren Eltern nicht nur eine Vielzahl gesundheitsrelevanter Gene, sondern auch Informationen zu erworbenen Eigenschaften jenseits der DNA, und zwar auf anderer stofflicher Grundlage, die an die nächste Generation weitergegeben wird – und damit die Wahrscheinlichkeit, ob und wie stark bestimmte Erkrankungen in Erscheinung treten.“, sagt DZD-Vorstand Prof. Martin Hrabě de Angelis. Um diese komplexen Prozesse zu verstehen und dabei genetische Ursachen sicher ausschließen zu können, untersucht man am DZD Mäuse mit bekannter Gen-Ausstattung. Mit ihrer Hilfe konnten Forschende schon vor Jahren zeigen, dass übergewichtige Tiere ihre Fettleibigkeit durch epigenetische Mechanismen auf die Nachkommen vererben. Dabei ließen sich – jeweils unterschiedliche – Einflüsse beider Elternteile nachweisen.

Der väterliche Einfluss
„Während die Mütter über den gesamten Zeitraum der Schwangerschaft und Stillzeit in engem Austausch mit ihrem Kind sind, bringen sich Väter nur für eine sehr kurze Zeit während der Empfängnis ins Spiel“, erklärt Dr. Raffaele Teperino, Leiter der Arbeitsgruppe Umwelt-Epigenetik am DZD. Dennoch ist der Molekularbiologe überzeugt, dass sich der väterliche Einfluss auf den Nachwuchs nicht auf die Gene beschränkt. Um diese These zu prüfen, arbeitet auch er mit genetisch klar charakterisierten Mäusen. Die Nager müssen nicht hungern, sondern dürfen fressen, so viel sie wollen – allerdings nur tagsüber. Weil Mäuse normalerweise nachts fressen, ist das für die Tiere eine sehr unnatürliche Situation. „Wenn wir sie nur tagsüber füttern, zwingen wir sie, ihren Schlaf-Wach-Rhythmus zu ändern. Diese Umstellung bedeutet eine einschneidende Störung ihres Lebensstils – und ist daher gut geeignet, um die epigenetischen Auswirkungen von Umwelteinflüssen zu untersuchen“, so Teperino.
WIR ERBEN VON UNSEREN ELTERN NICHT NUR EINE VIELZAHL GESUNDHEITSRELEVANTER GENE, SONDERN AUCH DEREN EPIGENETISCHE PROGRAMMIERUNG.
Der Schlaf-Wach-Rhythmus
Der Schlaf-Wach-Rhythmus ist Teil des zirkadianen Rhythmus. Dieser synchronisiert die Aktivitäten von Lebewesen mit dem 24-Stunden-Zyklus, den die Erdentage vorgeben. Damit dies gelingt, besitzen mehrzellige Organismen in praktisch jeder Körperzelle eine Art innere Uhr: Diese stimmt molekulare Prozesse aufeinander ab, um die Funktionsfähigkeit des Gesamtorganismus zu gewährleisten, und sorgt insbesondere für das kontrollierte Ablesen von Genen. Störungen dieses fein austarierten Systems haben gravierende Auswirkungen auf den Stoffwechsel – mit weitreichenden Folgen für die Gesundheit. So hinterließ der gestörte Schlaf-Wach-Rhythmus auch an Teperinos Mäusen messbare Spuren. Zwar gewöhnten sich die Nager binnen weniger Tage an die Umstellung und verhielten sich unauffällig; auch fraßen und wogen sie während des 30 Tage dauernden Versuchs ähnlich viel wie Kontrolltiere mit natürlichem Tagesrhythmus. Dennoch waren wichtige Prozesse in ihrem Körper aus dem Takt geraten: Mehr als 8000 Gene ihrer Leberzellen zeigten ungewöhnliche Aktivitätsmuster. Zudem fanden sich in ihrem Blut abnormale Konzentrationen wichtiger Hormone: Insulin war den ganzen Tag über in größeren Mengen vertreten, Corticosteron – ein wichtiger Regulator des Zucker- und Eiweißstoffwechsels – in deutlich geringeren.
Die größte Überraschung aber brachte die Untersuchung der Nachkommen von aus dem Takt gebrachten Mäusemännchen: Auch sie zeigten gravierende Auffälligkeiten – obwohl sowohl ihre Mütter als auch sie selbst im natürlichen Schlaf-Wach-Rhythmus gehalten wurden. „Die Jungen hatten eine verzögerte Gehirnentwicklung. Außerdem fraßen sie mehr, schliefen weniger und hatten deutlich höhere Konzentrationen an Blutzucker und Corticosteron als die Jungen unbelasteter Väter. Ihr Rhythmus war in gewisser Weise durcheinander – als ob sie sich an die unnormale Umgebung ihrer Väter erinnern könnten“, fasst Teperino zusammen. Paarten sich die Männchen hingegen erst zwei Wochen nach Beendigung der erzwungenen Schlaf-Wach-Umstellung, dann zeigten ihre Jungen keinerlei Abnormalitäten.
Epigenetische Mechanismen
Sind hier epigenetische Mechanismen am Werk - und falls ja, wie erzielen sie ihre Wirkung? Eine gründliche Analyse der Spermien brachte keine Lösung. Denn die Spermien belasteter und unbelasteter Mäusemännchen unterschieden sich weder in ihren Genen noch in deren epigenetischen Signaturen. Offenbar wirkt sich der gestörte Schlaf-Wach-Rhythmus der Väter also nicht auf die Keimzellen aus. Fündig wurde das DZD-Team schließlich in der Samenflüssigkeit: Sie enthielt, ebenso wie das Blut der aus dem Takt gebrachten Nager, abnormal wenig Corticosteron. Damit war eine plausible Erklärung der Phänomene gefunden.
KINDER VON VÄTERN IN NACHTSCHICHTEN WEISEN ERHÖHTE CORTICOSTERON-WERTE AUF.
„Die Samenflüssigkeit ist eine Schnittstelle zwischen Mutter und Vater; sie vermittelt während der Empfängnis die Kommunikation zwischen den Eltern," so Teperino: „Ein veränderter Corticosteron-Spiegel in der Samenflüssigkeit sendet ein problematisches Signal an die Mutter. Daraus resultiert eine Funktionsstörung der Plazenta, die wiederum eine verzögerte Entwicklung des Fötus zur Folge hat. Unsere Ergebnisse zeigen, dass ein gestörter zirkadianer Rhythmus des Vaters während der Zeugung die Gesundheit der Nachkommen entscheidend beeinflusst."
Ähnliche Zusammenhänge bestehen auch beim Menschen, wie eine laufende Studie in Spanien nahelegt. „Dazu haben wir die Corticosteron-Werte im Speichel von Kindern gemessen, deren Väter in Nachtschichten arbeiten. Normalerweise sollten die Werte am frühen Morgen am höchsten sein und nachts absinken. Stattdessen bleiben sie aber den ganzen Tag über hoch“, so Teperino. Künftig soll durch die Bauchdecke von schwangeren Frauen auch die Hirnaktivität von Babys gemessen werden, deren Väter Nachtschichten arbeiten oder deren Mütter an Schwangerschaftsdiabetes – und damit höchstwahrscheinlich an einer nicht voll funktionsfähigen Plazenta – leiden. Dieses Forschungsprojekt wird vom DZD finanziert; erste Ergebnisse könnten bis Ende 2026 vorliegen.