Typ-1-Diabetes ist eine Autoimmunerkrankung, die überwiegend im frühen Kindes- und Jugendalter auftritt. Dabei zerstören fehlgeleitete Immunzellen gezielt jene Zellen in der Bauchspeicheldrüse, die das blutzuckersenkende Hormon Insulin produzieren. Weil es dem Körper fortan an Insulin mangelt, sammelt sich der mit der Nahrung aufgenommene Zucker im Blut an – und fehlt den übrigen Organen als Energiequelle. Erkrankte sind folglich ihr Leben lang auf künstliches Insulin angewiesen.
Prof. Carolin Daniel, Immunologin am Deutschen Zentrum für Diabetesforschung (DZD), will herausfinden, was das Immunsystem hier aus dem Takt bringt. Im Fokus ihrer Forschungsarbeiten stehen die regulatorischen T-Zellen, kurz Tregs.
Frau Daniel, welche Funktion haben die Tregs?
Das Immunsystem hält vielfältige Mechanismen bereit, um unseren Körper zu schützen. Bestimmte Zellen sind darauf getrimmt, Eindringlinge wie Bakterien oder Viren anzugreifen. Andere Zellen sorgen dafür, dass körpereigene Gewebe und Organe von eben diesen Angriffen verschont bleiben. Dieses Gleichgewicht bezeichnen wir als Immuntoleranz. Bei gesunden Menschen tragen die Tregs ganz wesentlich zur Immuntoleranz bei, indem sie körpereigene Strukturen schützen. Man kann Tregs also als Blauhelmsoldaten des Immunsystems betrachten.
Warum braucht man denn als gesunder Mensch überhaupt eine Blauhelmtruppe? Eigentlich sollte der Körper doch zwischen „fremd“ und „selbst“ unterscheiden und Eigenes schützen, statt es anzugreifen?
Das stimmt. Normalerweise werden im Thymus – das ist quasi das Trainingslager des Immunsystems – fehlgeleitete Zellen aussortiert, die Eigenes angreifen. Doch diese negative Selektion ist nicht perfekt und so können einige dieser fehlgeleiteten, als autoreaktiv bezeichneten Immunzellen über die Blutbahn in die Peripherie des Körpers gelangen.
Und hier kommen die Tregs ins Spiel?
Genau. Einige von ihnen werden direkt im Thymus darauf trainiert, die wenigen autoreaktiven Zellen zu bändigen, die der negativen Selektion entkommen sind. Darüber hinaus gibt es aber noch weitere Tregs, die erst in der Peripherie heranreifen: Sie entstehen aus naiven T-Zellen, die erst dann aktiv werden, wenn sie mit ganz bestimmten autoreaktiven Zellen in Kontakt kommen. Diesen Vorgang zu verstehen, ist ein Schwerpunkt unserer Forschungsarbeit.
Was genau wollen Sie herausfinden?
Wir wollen wissen, unter welchen Bedingungen sich diese naiven T-Zellen zu spezifischen Tregs entwickeln, um ganz bestimmte autoreaktive Immunzellen gezielt in Schach zu halten – zum Beispiel diejenigen, die den Typ-1-Diabetes auslösen. Wenn wir diese Bedingungen kennen, können wir sie möglicherweise durch gezielte therapeutische Eingriffe steuern.
Was läuft schief im Körper von Patienten mit Typ-1-Diabetes?
Da haben wir genau den Fall, dass autoreaktive Immunzellen körpereigene Zellen – nämlich die insulinproduzierenden Betazellen der Bauchspeicheldrüse – als fremd betrachten und zerstören. Und die große Frage ist: Warum greifen hier die Tregs nicht ein und verhindern das? Haben sie vielleicht „vergessen“, was ihre Identität ist und welche Aufgaben sie haben? Wie kommt es zu diesem Versagen und wie könnte man da therapeutisch gegensteuern?
BEI GESUNDEN MENSCHEN TRAGEN REGULATORISCHE T-ZELLEN GANZ WESENTLICH ZUR IMMUNTOLERANZ BEI.

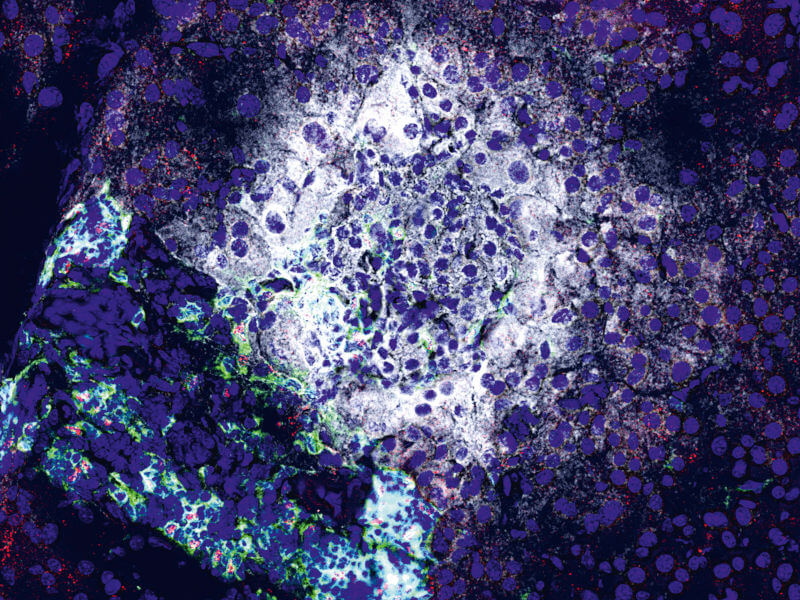
Auf dieser Mikroskopaufnahme sind die Tregs rot eingefärbt. DZD-Immunologin Carolin Daniel stellt die regulatorischen T-Zellen in den Fokus ihrer wissenschaftlichen Arbeit.
Wie untersuchen Sie diese komplexen Fragen?
Besonders hilfreich sind hier die Kohortenstudien von Anette-Gabriele Ziegler, die das Institut für Diabetesforschung am DZD-Partner Helmholtz Munich leitet. In diesen Studien wird seit Jahrzehnten die gesundheitliche Entwicklung von Kindern und Jugendlichen mit Typ-1-Diabetes oder einem erhöhten Erkrankungsrisiko untersucht. Daher konnten wir Immunzellen im Blut von Kindern in einem sehr frühen Krankheitsstadium analysieren, wo noch keine sichtbaren Diabetes-Symptome auftreten, aber schon bestimmte Autoimmunreaktionen nachweisbar sind.
Zurück zu den Tregs: Welchen Beitrag leisten sie zur Entstehung der Krankheit?
Zunächst wollten wir unsere Vermutung überprüfen, ob Tregs das Voranschreiten eines Typ-1-Diabetes beeinflussen. Dazu haben wir aus der Kohorte zwei Gruppen von Kindern verglichen, die unterschiedlich schnell an Typ-1-Diabetes erkrankt sind. Bei den einen brach die Krankheit innerhalb weniger Monate oder Jahre aus, bei den anderen erst nach mehr als einem Jahrzehnt. Und tatsächlich fanden wir bei Ersteren deutlich weniger schützende Tregs als bei Letzteren. Wir vermuten, dass dies unter anderem an einer gestörten Entwicklung und einer verminderten Stabilität von spezialisierten Tregs liegt – oder an einem von beidem.
FORSCHUNGSBEFUNDE AUS DER IMMUNOLOGIE UND DER MEDIZIN WERDEN MIT NEUEN BIOENGINEERING-TECHNOLOGIEN FÜR THERAPEUTISCHE ANWENDUNGEN NUTZBAR GEMACHT.
Was verursacht diese gestörte Entwicklung?
Hier hatten wir schon früh microRNAs im Visier. Denn aus anderen Studien war bekannt, dass diese kurzen RNA-Stränge eine breite Palette von Genen und damit sogar komplexe Zustände des Immunsystems regulieren können. Also haben wir untersucht, welche der vielen Hundert verschiedenen microRNAs in den T-Zellen gesunder Kinder in anderen Konzentrationen zu finden sind als bei Kindern mit einem frühen Stadium des Typ-1-Diabetes. So konnten wir mehrere microRNAs identifizieren, die bei den von Typ-1-Diabetes betroffenen Kindern deutlich häufiger vorkommen.
Was bewirken diese microRNAs?
Sie blockieren wichtige Signalwege, die unter anderem an der Entstehung und Funktion von Tregs beteiligt sind. Das konnten wir belegen, indem wir die microRNAs ihrerseits blockiert haben – mit kurzen synthetischen RNA-Strängen, die sich gezielt an die microRNAs anlagern und sie dadurch lahmlegen. Wir haben mit diesen Inhibitoren sowohl in Zellkulturen, als auch bei diabeteskranken Mäusen wichtige Ergebnisse erzielt: Bei den Tieren, denen wir Inhibitoren verabreicht hatten, fanden wir zwei Wochen nach der Behandlung eine geringere Autoimmunreaktion und gleichzeitig mehr schützende Tregs in der Bauchspeicheldrüse als bei Mäusen einer unbehandelten Kontrollgruppe.
Könnte man diese Inhibitoren nicht auch betroffenen Kindern und Jugendlichen verabreichen?
Das ist unser langfristiges Ziel! Doch auf dem Weg dahin sind noch einige Hürden zu nehmen. Zunächst wollen wir die Inhibitoren bei humanisierten Mäusen testen; das sind Mäuse, deren eigenes Abwehrsystem durch menschliche Immunzellen ersetzt wurde. Außerdem wollen wir eine entscheidende und bislang ungelöste Frage klären: Wie können wir die microRNAs zielgerichtet nur in den insulinspezifischen T-Zellen blockieren, die die fatale Autoimmunreaktion in der Bauchspeicheldrüse antreiben? Denn diese microRNAs können ja auch in anderen Körperzellen vorkommen und dort wichtige Funktionen erfüllen, die wir keinesfalls beeinflussen wollen.
Wie wollen Sie dieses Problem lösen?
Wir verfolgen mehrere Ansätze. Vielversprechend sind so genannte Nano-Carrier, die wir zusammen mit Claus-Michael Lehr am Helmholtz- Institut für Pharmazeutische Forschung Saarland entwickeln. Das sind winzige Transportsysteme, die die microRNA-Inhibitoren zielgenau in die richtigen T-Zellen einschleusen sollen. Ein anderes Konzept setzt darauf, die microRNA-Inhibitoren durch chemische Bindungen an bestimmte Antikörper zu koppeln, die an die T-Zellen binden und von ihnen aufgenommen werden. An der Entwicklung solcher Inhibitor-Antikörper-Konjugate arbeiten wir zusammen mit dem Team von Matthias Meier am Helmholtz Pioneer Campus. Das ist eine Stärke der Deutschen Zentren der Gesundheitsforschung: Forschungsbefunde aus der Immunologie und Medizin mit neuen Technologien des Bioengineerings für therapeutische Anwendungen nutzbar zu machen.
An welche Anwendungen denken Sie?
Unsere Erkenntnisse über Tregs sind nicht nur für Typ-1-Diabetes relevant, sondern auch für a dere Autoimmunerkrankungen wie etwa Multiple Sklerose oder Rheumatoide Arthritis. Denn auch hier will man eine überschießende Immunantwort kontrollieren, was sich unter anderem durch die gezielte Stärkung der jeweils relevanten Tregs erreichen ließe. Dieses Wissen lässt sich auch dazu nutzen, das genaue Gegenteil zu erreichen – und dann zur Bekämpfung von Krebs anzuwenden: Denn in diesem Fall möchte man die Tregs schwächen, weil sie den Tumor beschützen. Das wäre also die umgekehrte Anwendung dessen, was wir bei Typ-1-Diabetes anstreben.
DIE ERKENNTNISSE LASSEN SICH AUCH ZUR KREBSBEKÄMPFUNG NUTZEN.


