Die Bilder laufen in einer schier endlosen Folge über den Monitor: Ein Baum im Sonnenschein. Ein altmodisches Wohnzimmer. Ein gepflegter Garten. Ein Esstisch. Eine weitläufige Wiese. 80 Fotografien in acht Minuten, sechs Sekunden pro Bild, und jedes Mal müssen die Probanden per Knopfdruck angeben, ob das Foto eine Außenaufnahme ist oder einen Innenraum zeigt. „Die ganze Zeit über beobachten wir im Hirnscanner, was währenddessen im Kopf vor sich geht“, sagt Emrah Düzel. Für den Neurologie-Professor und sein Team war diese Aufgabe der Schlüssel zu einer wichtigen Entdeckung im Bereich der Alzheimer-Forschung.

Für die Forschenden ist bei ihrer Arbeit noch ein weiterer Aspekt entscheidend, den Emrah Düzel griffig als „statistische Power“ bezeichnet: Es müssen möglichst viele Probanden untersucht werden und die Gruppe dieser Testpersonen muss sorgfältig zusammengestellt sein. Am DZNE gibt es dafür die besten Voraussetzungen: DELCODE heißt eine klinische Studie, an der rund 1.000 Erwachsene beteiligt sind. Sie kommen aus dem gesamten Bundesgebiet und werden seit 2014 jedes Jahr untersucht. Zehn Studienzentren quer durch Deutschland erheben die Daten und damit diese miteinander vergleichbar sind, müssen die Untersuchungen und Tests bis ins kleinste Detail aufeinander abgestimmt sein – das bedeutet einen gewaltigen Aufwand, der weltweit noch nie so betrieben wurde. Das DZNE profitiert dabei von seinen zahlreichen Standorten im Land. „Für uns ist das Entscheidende: Wir bekommen eine viel größere Zahl von Probanden zusammen als das in einem einzigen Zentrum möglich wäre“, sagt Emrah Düzel. Erfasst ist eine große Bandbreite unterschiedlicher Patientinnen und Patienten: von jenen, die bei sich selbst erste Gedächtnisschwierigkeiten feststellen, ohne dass diese sich schon objektiv messen lassen, bis hin zu jenen mit fortgeschrittenen Alzheimer-Symptomen. „Wir wissen: Wenn erste Demenz-Anzeichen auftreten, ist das Gehirn schon erheblich geschädigt“, sagt Düzel. Die Erkrankung entwickelt sich im Gehirn über Jahre und sogar Jahrzehnte hinweg, ohne dass betroffene Personen davon auch nur etwas ahnen.
WENN ERSTE DEMENZ-ANZEICHEN AUFTRETEN, IST DAS GEHIRN SCHON ERHEBLICH GESCHÄDIGT.
Suche nach frühen Indizien
An diesem Punkt liegt eine der großen Herausforderungen für die Alzheimer-Forscher: Gibt es irgendwelche Indizien, die frühzeitig darauf hinweisen, dass sich die Krankheit im Hintergrund still und heimlich entwickelt? Um Hinweise auf solche frühen Indikatoren zu finden, bezieht die DELCODE-Studie ganz bewusst auch Personen in einem Frühstadium der Erkrankung ein und begleitet sie über viele Jahre hinweg, sodass auch kleine Veränderungen messbar sind. Jedes Jahr lösen die Probandinnen und Probanden die Aufgaben im funktionellen MRT und jedes Jahr wird ihr Liquor analysiert – eine Flüssigkeit, die auch als Nervenwasser bezeichnet wird.
Emrah Düzel hat sich innerhalb der Studie auf einen besonders rätselhaften Aspekt von Alzheimer konzentriert. Forschende beobachten schon lange, dass sich bestimmte Proteine im Gehirn von Patientinnen und Patienten ansammeln – sie bilden Protein-Klumpen, über deren Rolle bei der Entstehung von Alzheimer es die unterschiedlichsten Theorien gibt. Amyloid heißt eines dieser Proteine, Tau ein anderes. „Dass Ablagerungen von Tau-Proteinen im sogenannten Hippocampus und in benachbarten Hirnbereichen das Erinnerungsvermögen beeinträchtigen, ist schon lange bekannt“, sagt Düzel. Beim Amyloid hingegen hat man bislang keinen Zusammenhang mit der Gedächtnisleistung gefunden. Unter Fachleuten ist deshalb umstritten, ob es sinnvoll ist, Amyloid-Klumpen – sogenannte Plaques – medizinisch zu bekämpfen, wenn sie in einer frühen Demenz-Phase entdeckt werden. „Ich wollte untersuchen, ob es einen Zusammenhang gibt zwischen Amyloid und Tau“, sagt Emrah Düzel: „Wie wirken sie auf die Hirnfunktion? In welcher Hirnregion entsteht dieser Effekt? Genau dafür brauchen wir die Studie und die detaillierten Untersuchungen.“
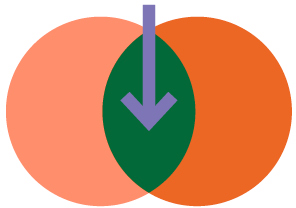
Hohe Belastung durch zwei Proteine
Als sich Emrah Düzel mit seinem Team über die gewaltigen Datenmengen beugte, schälte sich bald ein bemerkenswertes Bild heraus: Die Gedächtnisleistung der Probanden ließ nach, je höher die Tau-Konzentration in ihrem Gehirn war – aber nur dann, wenn gleichzeitig die Amyloid-Belastung hoch war. „Man kann also sagen, dass eine hohe Belastung durch beide Proteine die wahrscheinliche Ursache für eine beeinträchtige Gedächtnisleistung ist“, bilanziert Düzel. Er betrachtete die Daten aus den verschiedensten Perspektiven: Was ist mit den Probandinnen und Probanden, die zwar eine hohe Tau-Konzentration haben, aber keine auffälligen Amyloid-Werte? Oder mit jenen, die hohe Amyloid-Werte haben, aber eine niedrige Tau-Konzentration? Wie er es auch drehte und wendete, das Ergebnis war jedes Mal das gleiche: Wenn beide Proteine gemeinsam in hoher Menge auftreten, ist die Auswirkung auf das Gedächtnis am verheerendsten.
ARZNEIEN, DIE AMYLOID EINDÄMMEN, KÖNNEN IM KAMPF GEGEN DIE DEMENZ HELFEN.
Für Alzheimer-Therapien folgt daraus ein klarer Schluss: Arzneien, die Amyloid eindämmen, können im Kampf gegen die Demenz helfen. Ein Rückhalt für die Forschung nach entsprechenden Wirkstoffen. Für Emrah Düzel geht die Arbeit daher erst richtig los. Denn mit jedem gelösten Rätsel öffnet sich der Blick auf etliche weitere ungeklärte Fragen. „Für uns ist zum Beispiel völlig unklar, wie Tau für sich genommen wirkt“, sagt Düzel. Er hält die fünf Finger seiner Hand in die Höhe, sie sollen Nervenzellen symbolisieren: „In einem gesunden Gehirn läuft der Signal-Austausch über alle diese Nervenzellen. Was aber passiert, wenn Tau diese Verbindungen beeinträchtigt?“
Düzel deckt seine andere Hand über drei der fünf Finger. Klar: Die Gedächtnisleistung lässt nach. Verändert Tau aber die Nervenzellen, sodass der Schaden irreparabel ist? Oder blockiert es den Austausch lediglich, sodass die volle Funktion wiederhergestellt ist, wenn man das Tau beseitigt? „Das ist ein sehr wichtiger Aspekt, den wir klären müssen“, sagt Emrah Düzel. Mit ihrer klinischen Forschung nehmen er und sein Team gleich die nächste Herausforderung in den Blick.