Wenn Pharmakologen forschen, dann buddeln sie sich durch Datenbanken voller Substanzen, die als Arzneimittel in Frage kommen. Sie brüten über möglichen Mechanismen neuer Medikamente, bevor diese dann in klinischen Studien getestet werden. Bei Professor Wolfram Zimmermann von der Universität Göttingen ist das anders. Er ist Pharmakologe, und er leitet aktuell eine klinische Studie. Dafür geht er operieren – sechsmal bereits, und noch drei weitere Male bis Ende 2022.
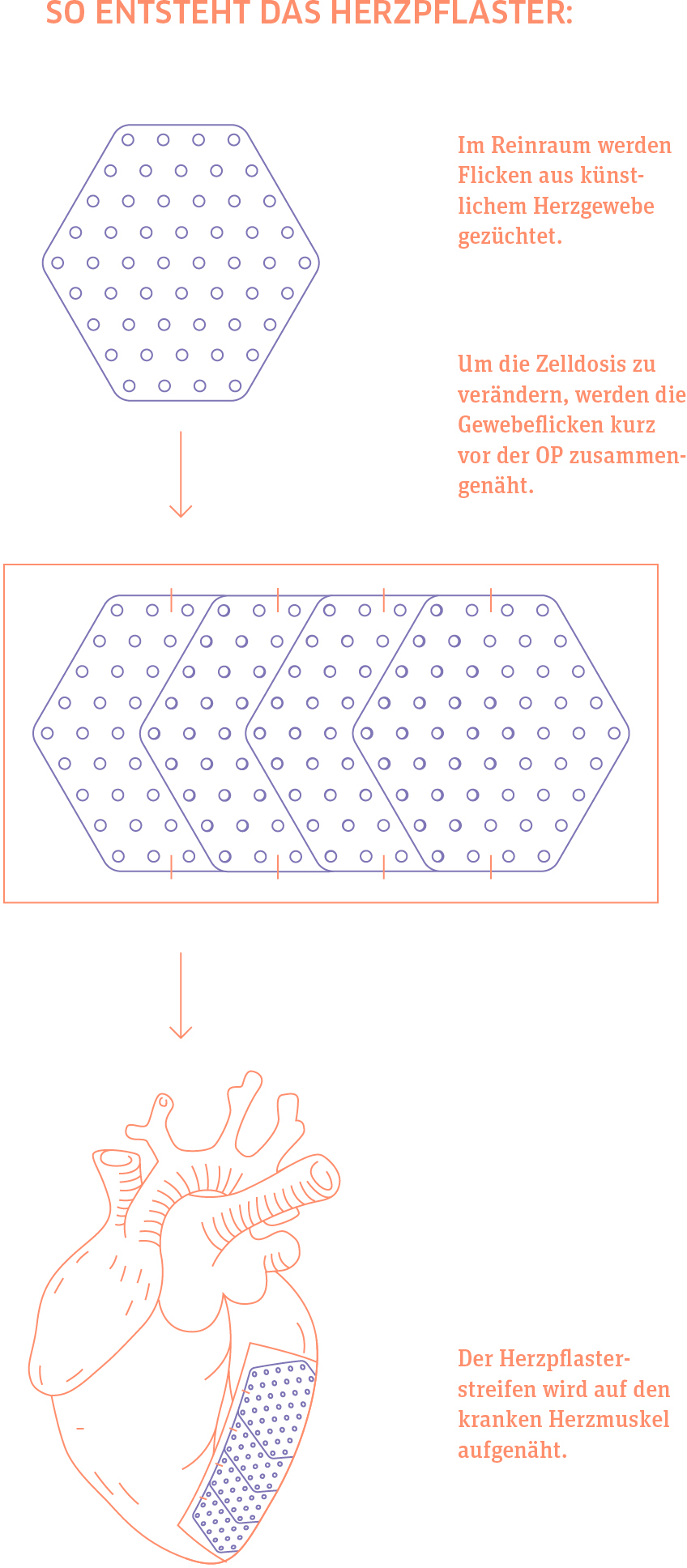
Natürlich operiert er nicht selbst. Während sich im OP-Saal ein Herzchirurg bei einem Patienten mit schwerer Herzschwäche minimalinvasiv zwischen zwei Rippen hindurch in den Herzbeutel vortastet, hantiert Zimmermann am Nachbartisch mit zwei biokompatiblen Membranen, jede knapp 10 mal 5 Zentimeter groß. Auf diese Membranen näht er mit einem weiteren Chirurgen kleine Gewebefetzen, mehrere Lagen übereinander. Darin enthalten sind Herzmuskelzellen und Bindegewebszellen, die in den Wochen vor dem Eingriff aus menschlichen Stammzellen herangezüchtet wurden. Durch den Zwischenrippenraum hindurch werden die Konstrukte kunstvoll auf der Herzvorderwand platziert und dort – Membran nach außen, Gewebeschicht nach innen – mit Nähten befestigt. Das Herz schlägt derweil weiter. Die Patienten sind narkotisiert, brauchen aber keine Herz-Lungen-Maschine.
Hoffnung für Patienten mit schwerster Herzschwäche
Was an den DZHK-Standorten Göttingen und Lübeck unter dem Namen BioVAT-HF-DZHK20-Studie stattfindet, ist weltweit einmalig: „Es ist eine von wenigen klinischen Studien, bei denen in großem Umfang Zellen transplantiert werden, die aus menschlichen Stammzellen herangezüchtet wurden“, so Zimmermann. Als Ausgangsmaterial nutzen die Göttinger so genannte iPS, induzierte pluripotente Stammzellen. Das sind Stammzellen, die aus Geweben erwachsener Menschen oder auch aus Nabelschnurgewebe herangezüchtet werden. Dass das möglich ist, hatte der japanische Forscher Shinya Yamanaka 2006 in Experimenten gezeigt, die ihm den Medizin-Nobelpreis einbrachten. Einmal hergestellt, können iPS zu fast jeder beliebigen menschlichen Zelle ausdifferenziert werden.
Genau das passiert in Göttingen: Die Wissenschaftler nutzen die iPS-Zellen, um daraus menschliche Herzmuskel- und Bindegewebszellen herzustellen. Aus diesen wiederum „basteln“ sie eine Art Gewebe-Patch, der dann für die Transplantation genutzt wird. Diese „Pflaster“ sind derzeit vor allem für schwerkranke Menschen vorgesehen: Patientinnen und Patienten, bei denen das Herz nicht mehr gut pumpt und die eine Herztransplantation oder eine mechanische Herzpumpe benötigen. Solche ausgeprägten Formen der Herzschwäche können nach großen Herzinfarkten entstehen, aber auch die Folge von entzündlichen oder genetischen Herzmuskelerkrankungen sein. „Diese Menschen haben einen sehr hohen Behandlungsbedarf“, betont Zimmermann. „Jeder Fünfte stirbt innerhalb eines Jahres.“
Ein Viertel des Herzens wird ersetzt
Für medizinische Therapien, bei denen lebende Gewebe oder genetisches Material auf Patienten übertragen werden, haben Zulassungsbehörden wie das Paul-Ehrlich-Institut (PEI) einen eigenen Namen, nämlich Advanced Therapy Medicinal Product, kurz ATMP. Bei den klinischen Studien ist das PEI eng eingebunden – anders als bei Arzneimittelstudien. Was die DZHK-Studie so besonders macht ist, dass Zellen in großem Umfang übertragen werden: „Wir werden bis Jahresende vermutlich mehr iPS-basierte Zellen transplantiert haben als alle anderen iPS-Projekte weltweit zusammen“, so Zimmermann.
Derzeit nähern sich die Göttinger ihrer Zieldosis schrittweise an. Jedes Gewebestück, das auf dem Patch befestigt wird, enthält 40 Millionen Zellen. Am Ende soll jeder Patch mit zehn Gewebestücken ausgestattet werden, und es werden zwei Patches bei jedem Patienten aufgenäht. Pro Therapie werden dann also 800 Millionen Zellen übertragen: „Ein menschliches Herz besteht aus etwa 4 Milliarden Zellen. Die Annahme war, dass bei schwerer Herzschwäche etwa ein Viertel davon verloren geht.“
Die 800 Millionen Zellen in den Patches beteiligen sich an der normalen Kontraktion des Herzens. Das wurde im Vorfeld an Tiermodellen gezeigt, teils ebenfalls mit DZHK-Förderung: „Die Patches haben die Auswurfleistung des Herzens im Tiermodell um etwa zehn Prozentpunkte verbessert“, so Zimmermann. Ein gesundes Herz hat eine Auswurfleistung von über 60 Prozent. Patienten mit schwerer Herzschwäche liegen bei 30 Prozent und weniger. Steigt dieser Wert durch die Patches auf 40 oder 50 Prozent, dann kann das den Unterschied machen zwischen einem funktionierenden Alltag und ständiger Luftnot bei kleinster Belastung. „Man darf sich aber nicht vorstellen, dass die Patientinnen und Patienten sich sofort besser fühlen. Die Patches müssen zunächst einmal überleben und sie werden dann langsam an die Blutversorgung angeschlossen. Therapeutische Effekte erwarten wir innerhalb von ein bis drei Monaten.“
ES IST EINE VON WENIGEN STUDIEN, BEI DENEN ZELLEN TRANSPLANTIERT WERDEN, DIE AUS MENSCHLICHEN STAMMZELLEN HERANGEZÜCHTET WURDEN.